大阪大学医学部医化学トップページ > エネルギー代謝イメージング
生化学的タンパク質解析手法を中心とした、様々な分子の機能解明
心臓は刻々と変化する全身の循環血液需要に対応して即座に適応しなければならず、全身の臓器の中でも最もエネルギー(ATP)を消費します。フランクスターリング機構は1950年代に提唱された心臓生理の基本原理で、心臓は循環血液量の需要の増加に適応し、瞬時にその収縮性を上昇させ得るというものです。フランクスターリング機構の縦軸となる心拍出量は、心臓の酸素消費量、ミトコンドリアでのATP産生量に依存します。また、心臓外科手術時の低温処理によるATP消費の抑制、心不全治療におけるβ遮断剤によるATP消費の抑制は、心筋保護につながることが知られています。これらのことから、心臓でのATP代謝動態の解明は、その生理機能・病態を明らかにする上で必須と考えられます。
これまでに我々は、心筋の収縮性、エネルギー代謝、ATP産生制御をキーワードとし、生化学的タンパク質解析手法を中心として、様々な分子の同定と機能解析を行い、さらにそれを新たな心疾患治療法につなげるべく研究を進めてきました。
たとえば、2007年に発見したcardiac MLCKは、新たな心不全創薬の標的分子として製薬会社と共同研究をすすめています(下図)。
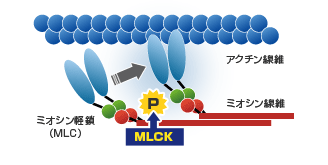
ミオシンATPaseの調節因子である心臓特異的ミオシン軽鎖リン酸化酵素(cardiac MLCK)を新規に同定しその心収縮性に与える効果を明らかにした。(JCI2007)
すべての臓器は、細胞内のATP濃度を一定に保つ堅牢なシステムを構築していることが知られ、殆どの生体活動のエネルギー源となるATPを細胞内で一定に保つことが重要と考えられます。
我々は、研究対象としての扱いにくさから未解明な部分が多く残される、心臓におけるATP代謝の分子機構を明らかにすることを目指しています。現在、分子探索を端緒とし、FRETプローブを使った新たな生細胞内ATP測定法といったイメージング技術を駆使し、心臓におけるATP代謝制御メカニズムの解明に取り組んでいます。この分子も新しい心疾患治療法の開発につながると考えています。